Perché l’acqua è un buon conduttore di elettricità?
Siamo stati tutti avvertiti fin da bambini: mai usare apparecchi elettrici con le mani bagnate o vicino a una pozza d’acqua. Questo consiglio salva-vita si basa sull’idea che l’acqua sia un eccellente conduttore di elettricità. Ma la verità è più sfumata e sorprendente: l’acqua pura, in realtà, è un pessimo conduttore. Il segreto della conducibilità elettrica dell’acqua che conosciamo non risiede nell’acqua stessa, ma in ciò che vi è disciolto dentro.

L’Acqua Pura (H₂O): Un Isolante Quasi Perfetto
Per capire il fenomeno, dobbiamo partire dalla molecola di H₂O. Una molecola d’acqua è elettricamente neutra, non ha una carica netta. L’elettricità, per definizione, è un flusso di particelle cariche, come gli elettroni. In un filo di rame, gli elettroni si muovono liberamente, trasportando la corrente. L’acqua pura, invece, non ha elettroni liberi. Le sue molecole sono strettamente legate e, sebbene esista un processo minimo chiamato autoionizzazione (in cui una molecola su milioni si scinde in ioni H+ e OH–), il numero di particelle cariche è così basso da renderla un isolante molto efficace.
Il “Superpotere” dell’Acqua: Un Solvente Eccezionale
Se l’acqua pura è un isolante, perché nella vita di tutti i giorni è così diversa? La risposta sta nella sua natura di molecola “polare”: ha una parte leggermente negativa (l’atomo di ossigeno) e due parti leggermente positive (gli atomi di idrogeno). Questa polarità le permette di attrarre e separare con grande efficacia gli ioni di altre sostanze, come i sali, dissolvendoli. È questo suo “superpotere” di solvente a preparare il terreno per la conducibilità.
I Veri Protagonisti: Ioni Disciolti
Allora, perché l’acqua del rubinetto conduce elettricità? La risposta sta negli ioni. Quando sostanze come sali, minerali o acidi, noti come elettroliti, si sciolgono in acqua, si scompongono in particelle cariche chiamate ioni. Prendiamo il comune sale da cucina, il cloruro di sodio (NaCl). Sciolto in acqua, si separa in uno ione sodio positivo (Na+) e uno ione cloruro negativo (Cl–). Sono questi ioni, ora liberi di muoversi nella soluzione, a fungere da “taxi” per la corrente elettrica. Quando si applica una tensione elettrica, gli ioni positivi migrano verso il polo negativo (catodo) e quelli negativi verso il polo positivo (anodo), creando un flusso di carica. Più ioni ci sono, maggiore è la conducibilità elettrica dell’acqua.
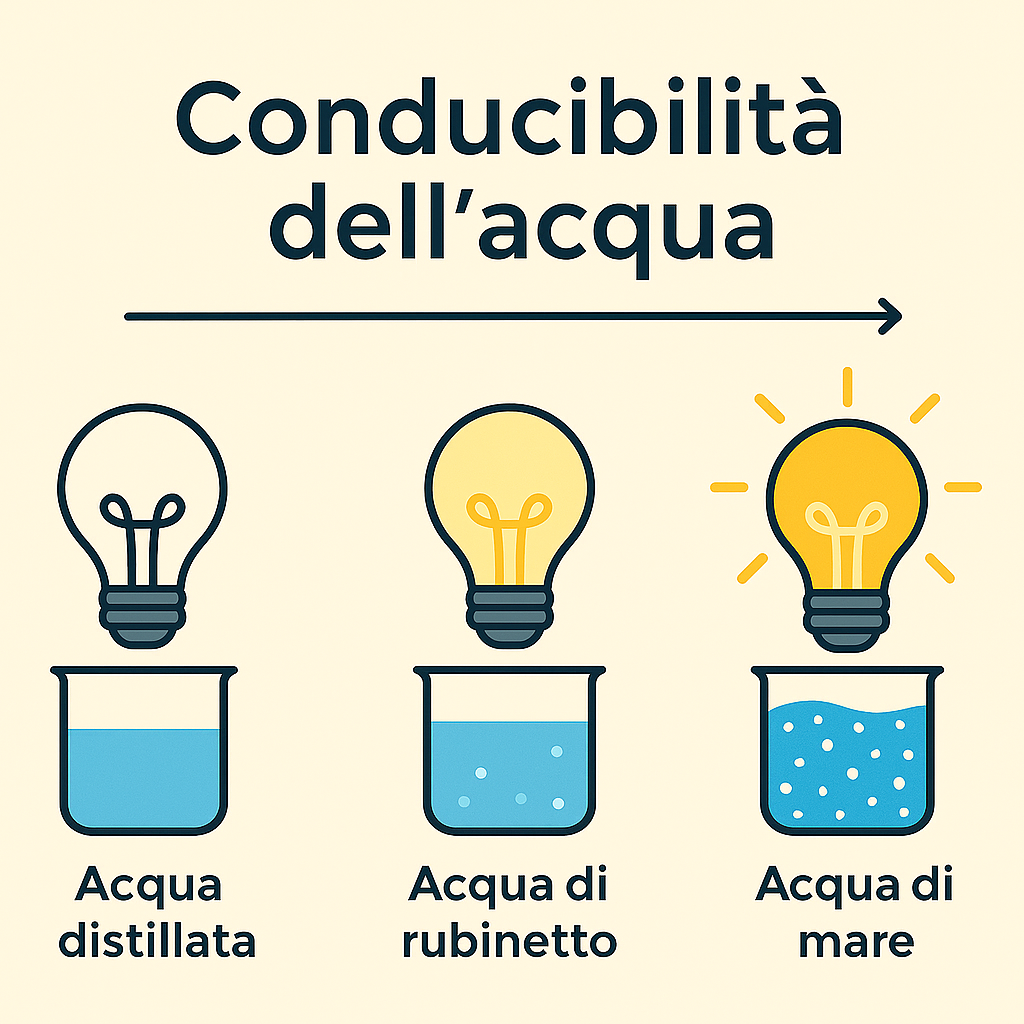
Dall’Acqua Distillata all’Acqua di Mare
Questo spiega le enormi differenze di conducibilità tra i vari tipi di acqua che incontriamo:
- Acqua distillata o deionizzata: È acqua quasi pura, privata di quasi tutti i sali minerali. La sua conducibilità è bassissima.
- Acqua del rubinetto: Contiene minerali disciolti come calcio, magnesio e sodio. Questi ioni la rendono un conduttore discreto.
- Acqua di mare: È ricchissima di sali disciolti, soprattutto NaCl. L’alta concentrazione di ioni la rende un ottimo conduttore di elettricità. Perché l’acqua del mare è salata?
Misurazione, Limiti e Applicazioni
La conducibilità dell’acqua si misura in microsiemens per centimetro (µS/cm) o millisiemens per centimetro (mS/cm), e uno strumento specifico, il conduttivimetro, viene usato per rilevarla. Questa misurazione è così importante che la legge la regolamenta: secondo il Decreto Legislativo 31/2001, ad esempio, la conducibilità dell’acqua del rubinetto in Italia non deve superare i 2.500 μS/cm per essere considerata potabile.
L’importanza di avere acqua priva di ioni è cruciale in alcuni settori industriali. L’industria dei semiconduttori, ad esempio, usa acqua “ultra-pura”, quasi totalmente priva di ioni, per pulire i microchip. Se venisse impiegata acqua normale, i minerali conduttori in essa disciolti creerebbero inevitabilmente dei cortocircuiti, danneggiando i delicati componenti elettronici.
Ecco perché, nonostante l’acqua pura sia un cattivo conduttore, l’avvertimento sull’uso di apparecchi elettrici vicino all’acqua comune rimane cruciale. Il pericolo di folgorazione in queste situazioni deriva da una combinazione di fattori: il nostro corpo è già un buon conduttore, essendo ricco di sali minerali, e l’acqua esterna crea un contatto perfetto per il passaggio della corrente. Quindi, il consiglio di stare lontani dall’acqua quando si maneggia l’elettricità è assolutamente valido, perché l’acqua che troviamo nella vita di tutti i giorni (dal rubinetto, dalla pioggia, in piscina) non è mai pura, ma sempre ricca di ioni che la rendono pericolosamente conduttiva.
| Tipo di acqua | Conducibilità (µS/cm) |
|---|---|
| Ultrapura (laboratorio) | 0,055 |
| Distillata comune | 0,5 – 3 |
| Pioggia media | ~50 |
| Rubinetto | 100 – 500 |
| Fiumi-laghi | 50 – 1 500 |
| Acqua di mare | 30 000 – 60 000 (≈ 54 000 tipico) |
Fonti e Approfondimenti
Per una spiegazione scientifica dettagliata, l’approfondimento della U.S. Geological Survey (USGS) sulla conducibilità chiarisce in modo eccellente come la corrente elettrica sia trasportata non dalle molecole di H₂O, ma dagli ioni di minerali e sali in essa disciolti. Questo spiega perché la conducibilità varia drasticamente a seconda della purezza dell’acqua. La voce dell’enciclopedia Treccani dedicata all’acqua ne descrive la natura polare, che la rende un solvente eccezionale, il vero motivo per cui l’acqua che incontriamo quotidianamente contiene sempre ioni. Infine, per chi volesse analizzare i dati quantitativi, risorse tecniche come quelle fornite da Atlas Scientific e Apure Instruments offrono tabelle comparative che illustrano numericamente l’enorme divario di conducibilità tra l’acqua distillata, quella del rubinetto e l’acqua di mare.





