Perché l’acqua bolle prima in montagna?
Ti è mai capitato di preparare un tè o di voler cuocere la pasta durante una gita in alta quota e notare qualcosa di strano? L’acqua sembra raggiungere l’ebollizione in un lampo, molto più in fretta che in città. Non è un’impressione: il fatto che l’acqua bolle prima in montagna è un fenomeno fisico reale con una spiegazione scientifica precisa, legata alla pressione atmosferica. Questo “bollire prima” significa che l’acqua raggiunge l’ebollizione in meno tempo perché deve arrivare a una temperatura più bassa dei classici 100 °C. Questo non solo cambia i tempi di ebollizione, ma ha conseguenze pratiche importanti, soprattutto in cucina. Scopriamo insieme perché questo accade e come adattarsi.

Pressione Atmosferica: il “Peso” dell’Aria che ci Schiaccia
Per prima cosa, dobbiamo capire cos’è la pressione atmosferica. Immagina l’atmosfera come un’immensa colonna d’aria sopra la nostra testa. Il peso di tutta quest’aria esercita una forza sulla superficie terrestre: questa è la pressione atmosferica. Al livello del mare, questa pressione è massima perché la colonna d’aria sopra di noi è più alta e densa. Tuttavia, man mano che saliamo di altitudine, la colonna d’aria si accorcia e l’aria stessa diventa più rarefatta. Di conseguenza, la pressione diminuisce. In parole semplici, in montagna c’è meno “peso” dell’aria che preme verso il basso.
Il Legame tra Pressione e Punto di Ebollizione
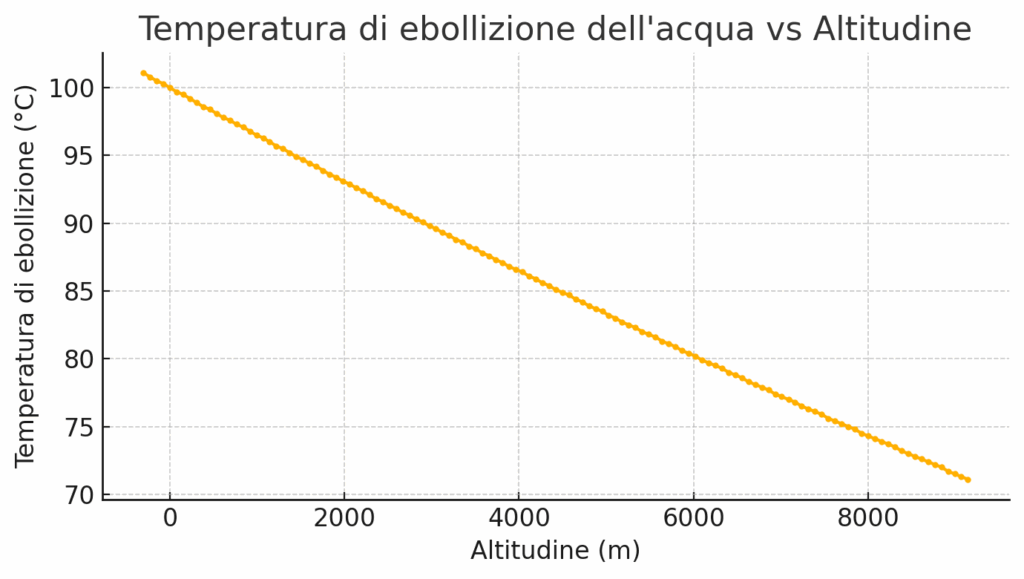
Qui arriviamo al cuore del fenomeno. L’ebollizione avviene quando le molecole d’acqua hanno abbastanza energia (calore) per trasformarsi in vapore e vincere la pressione dell’aria che le “schiaccia”. Al livello del mare, dove la pressione è alta (circa 1 atmosfera o 1013 millibar), l’acqua ha bisogno di raggiungere i 100 °C per avere l’energia sufficiente. A questa temperatura, la pressione del vapore dell’acqua eguaglia la pressione atmosferica esterna, permettendo la formazione delle bolle e l’ebollizione.
In montagna, invece, la pressione esterna è inferiore. Servirà quindi meno energia (e quindi meno tempo di riscaldamento), e di conseguenza una temperatura più bassa, perché la pressione del vapore superi quella atmosferica. In breve: meno pressione esterna significa meno “fatica” per l’acqua per bollire. Come regola generale, si può considerare che il punto di ebollizione scenda di circa 1 °C ogni 300 metri di altitudine. Questo è il motivo per cui l’acqua bolle prima in montagna, ma a una temperatura inferiore ai 100 °C. Ad esempio, sulla cima del Monte Bianco (4.809 m), bollirebbe a soli 84 °C circa, rendendo quasi impossibile cuocere certi alimenti senza una pentola a pressione. A questo punto, è utile chiarire un dubbio comune. A differenza dell’altitudine, che abbassa il punto di ebollizione, l’aggiunta di sale all’acqua ha l’effetto opposto: lo alza leggermente.
Un esempio estremo di questo principio è il cosiddetto “Limite di Armstrong”. A circa 19.000 metri di altitudine, la pressione è così bassa che l’acqua bolle a 37 °C, la normale temperatura del corpo umano. Il limite di Armstrong è, quindi, l’altitudine a cui la pressione atmosferica è così bassa che i liquidi corporei inizierebbero a bollire in un ambiente non pressurizzato, un fenomeno incompatibile con la vita. L’altezza esatta è stata stabilita tra i 18.900 e i 19.350 metri.
Le Conseguenze Pratiche: Cucinare in Altitudine
Se l’acqua bolle a una temperatura più bassa, significa che è meno calda. Un’acqua che bolle a 90 °C in alta montagna non cuoce i cibi con la stessa efficacia di un’acqua a 100 °C al livello del mare. Questo ha implicazioni dirette sui tempi di cottura. Alimenti come pasta, riso, uova o legumi richiederanno molto più tempo per cuocere completamente, perché il calore trasferito è inferiore. Non è raro dover aumentare i tempi di cottura del 25% o più.
Ecco alcuni esempi pratici:
- Pasta e riso: Impiegheranno più tempo per diventare teneri. Assaggia sempre prima di scolare.
- Uova sode: Un uovo che al mare diventa sodo in 10 minuti potrebbe richiederne 15 in montagna.
- Lievitazione: Anche gli impasti lievitano più velocemente a causa della minore pressione dell’aria, rischiando di collassare.
- Caffè e tè: La temperatura più bassa dell’acqua può portare a un’estrazione meno efficace degli aromi. L’acqua meno calda estrae gli aromi del caffè in modo diverso, spesso rendendolo più acido e meno corposo. Per questo motivo, i baristi che lavorano in alta quota devono spesso modificare i parametri di preparazione, come la finezza della macinatura e i tempi di estrazione, per ottenere un risultato ottimale.
Per ovviare a questo problema, gli alpinisti e chi vive in alta quota usa spesso la pentola a pressione. Questo strumento aumenta artificialmente la pressione al suo interno, permettendo all’acqua di bollire a temperature superiori ai 100 °C e garantendo una cottura rapida ed efficace.
Fonti e Approfondimenti
Per garantire l’accuratezza di questo articolo, abbiamo consultato fonti scientifiche e istituzionali. L’enciclopedia italiana Treccani, nella sua voce sull’ebollizione, chiarisce come questo processo dipenda dalla pressione esterna. Per chi fosse incuriosito dall’esempio estremo citato nell’articolo, la pagina sul Limite di Armstrong definisce l’altitudine precisa alla quale i liquidi corporei non protetti inizierebbero a bollire a causa della pressione quasi nulla, un concetto cruciale in aeronautica e medicina aerospaziale. Infine, le conseguenze pratiche del cucinare in montagna sono analizzate in dettaglio dalla guida “High Altitude Cooking” del Dipartimento dell’Agricoltura degli Stati Uniti (USDA), che fornisce tabelle e consigli specifici, spiegando perché alimenti come la pasta richiedono più tempo per cuocere e come l’uso della pentola a pressione risolva il problema.





